El átomo de Bohr se diferencia del modelo de Thompson en que define una serie de niveles de energía en los cuales los electrones se disponen dentro de la corteza, algo que Thompson no proponía, pues con su experimento de la lámina de oro sólo pudo llegar a la conclusión de que el átomo es, en esencia, espacio vacío y que sus masas se concentran en un núcleo de carga positiva. Para llegar a este modelo de niveles de energía, fue fundamental el descubrimiento de los espectros atómicos, exclusivos de cada tipo de átomo.
Bien es sabido que la luz blanca puede descomponerse, pasando a través de materiales que la refractan, como un prisma de cristal, en las diferentes longitudes de onda que la componen, dando lugar a un continuo de diferentes colores, desde los rojos hasta los violetas, que conocemos como “espectro electromagnético visible”. Los diferentes tipos de ondas de luz se caracterizan por su longitud de onda (cuánta distancia hay entre dos partes iguales de la onda que se propaga) y su frecuencia de vibración (cuánto vibra cada segundo), medidas que representan cuánta energía transmite cada onda; aquellas que tengan mayor longitud de onda y, por tanto, menos frecuencia, transportan menos energía que aquellas que tienen longitudes de onda más pequeña y, así, tienen más frecuencia. Ambas son, de hecho, magnitudes inversamente proporcionales, de manera que podemos usarlas para referirnos a lo mismo. Cada onda de luz visible es percibida por nuestros ojos con un color determinado según su longitud de onda/frecuencia: los rojos tienen frecuencias muy bajas y los violetas, muy altas; todas las ondas con frecuencias por debajo del rojo (infrarrojos) y todas las que tienen frecuencias por encima del violeta (ultravioleta) son invisibles para nosotros.
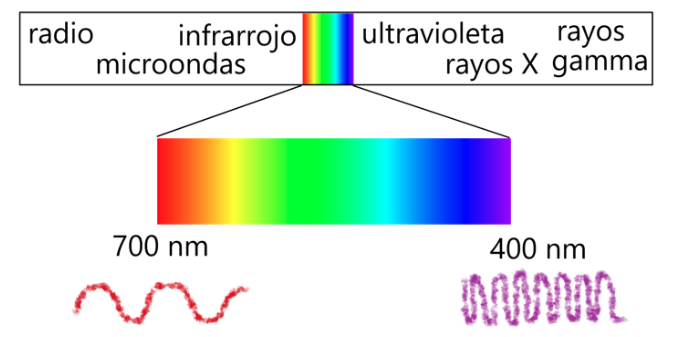
El espectro electromagnético se compone de muchas ondas de distintas longitudes y frecuencias; sólo el rango de ondas entre los 400 nm y los 700 nm de longitud de onda son visibles a nuestros ojos, pero usamos muchas otras para fines tan diversos como calentar nuestros alimentos, comunicarnos por teléfono, escuchar la radio, matar células cancerosas o hacernos radiografías.
Lo interesante es que los fotones de luz, las partículas que llevan asociadas estas ondas, se producen cuando las cargas eléctricas pierden o intercambian energía electromagnética en su movimiento, lo cual incluye a los electrones. En un átomo en un estado basal, normal, de energía, los electrones no pierden ni ganan energía en su movimiento, de manera que queda confinado en su nivel. Sin embargo, si un fotón de luz ajeno al átomo impacta sobre un electrón de la corteza con la energía suficiente, es posible que el electrón aumente su energía lo suficiente como para “subir de nivel”. Pasado un tiempo, el electrón pierde esta energía que ha ganado para subir de nivel reemitiendo un nuevo fotón de luz y bajando al nivel que le correspondía originalmente. Este fotón reemitido no tiene la misma energía ni, por tanto, frecuencia, que el fotón que impactó sobre el electrón originalmente, sino que es menor y representa, precisamente, la diferencia de energía que hay entre un nivel y otro dentro de cada átomo.
Los diferentes fotones que re-emite un átomo excitado que vuelve, por así decirlo, a tranquilizarse tienen una serie de longitudes de onda determinadas que, al final, pueden recogerse como una serie de ondas de luz de unas frecuencias y, por tanto, colores concretos dentro del espectro electromagnético visible. Es, precisamente, lo que conocemos como “espectro atómico” o “firma espectral”: el conjunto de longitudes de onda o bandas de color del espectro que emite un átomo excitado cuando regresa a su forma basal. Como estas firmas dependen del número de electrones y de niveles que el átomo tenga, cada tipo de elemento químico desprende unos colores determinados y tiene su propia firma. En esto es lo que se basó Bohr para determinar que en los átomos los electrones no se encuentran en un totum revolutum negativo, sino que se disponen en niveles concretos cuyas diferencias de energía se pueden medir de acuerdo a los fotones que los electrones reemiten cuando pierden energía para bajar a su nivel original.
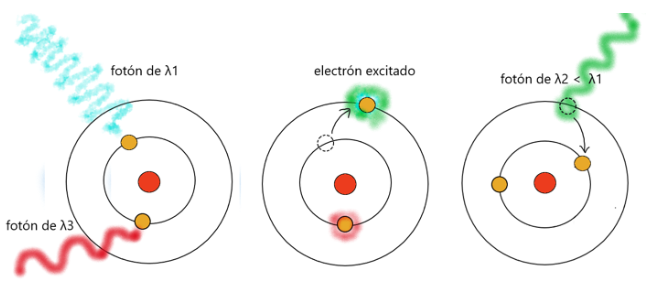
En este esquema, vemos como varios fotones inciden sobre los electrones del primer nivel de un átomo. El fotón rojo, de longitud de onda λ3, no tiene la energía suficiente para excitar al electrón, pero el fotón azul, de longitud λ1, es tan energético que puede promocionar un electrón a un nivel de energía superior. Cuando este electrón excitado libera la energía excedente para regresar a su nivel, lo hace en forma de otro fotón de una longitud de onda menor al original. Este electrón puede estar en un escalón energético o en otro, pero no en el medio, y la energía del fotón reemitido refleja ese desnivel que hay entre ambos.
La fluorescencia que emite la quinina de los gin-tonic cuando se la ilumina con luz ultravioleta en las discotecas o el color de los fuegos artificiales se basa en este mismo principio: la excitación de los electrones de los átomos con un aporte de energía extra (la radiación ultravioleta o una reacción de combustión, en los casos citados) que los obliga a remitir esa energía en exceso en forma de luz de determinadas longitudes de onda (es decir, colores). Los ensayos a la llama que se realizan en el laboratorio para determinar la composición de algunas sales a partir de analizar el color de las llamas que generan (por ejemplo, las sales de cobre arden con brillos esmeralda, mientras que las sales de litio arden con un profundo color carmesí) también beben de este principio, que nos ha permitido, de la misma manera, saber de qué están hechas las estrellas sin necesidad de acercarnos hasta ellas, simplemente analizando su luz.
 Proyecto Dodociencia es un proyecto por Hidden Nature está bajo licencia internacional Creative Commons Reconocimiento - No Comercial - CompartirIgual 4.0. Creado bajo el proyecto Hidden Nature. Puede encontrar permisos adicionales de los concedidos con esta licencia en nuestras políticas de privacidad
Proyecto Dodociencia es un proyecto por Hidden Nature está bajo licencia internacional Creative Commons Reconocimiento - No Comercial - CompartirIgual 4.0. Creado bajo el proyecto Hidden Nature. Puede encontrar permisos adicionales de los concedidos con esta licencia en nuestras políticas de privacidad



