Esta indefinición y la coexistencia de ciertos lugares del espacio donde es más probable encontrar al electrón tumbaron la idea de que los electrones son como balines que orbitan en torno al núcleo del átomo y tales órbitas se convirtieron en el concepto de “orbital”, las regiones del espacio donde es más probable encontrar a un electrón determinado. Si hubiera que buscar alguna analogía en el mundo que conocemos, lo más parecido serían las aspas de un ventilador al girar: el electrón forma, pues, una nube electrónica alrededor del núcleo atómico. El matiz está en que las aspas de un ventilador al girar “parece” que están en todas partes, mientras que el electrón “lo está” y sólo cuando hacemos una medición puntual forzamos a que se encuentre en un lugar en concreto donde podemos localizarlo.
Los orbitales electrónicos son regiones espaciales, ubicadas en los distintos niveles energéticos definidos por Bohr, en torno a un núcleo atómico donde los electrones se disponen. La forma y energía de los distintos orbitales creados por los electrones viene dada por una serie de parámetros que conocemos como “números cuánticos”, a saber, cuatro: el número cuántico principal, “n”, define el nivel energético del orbital y adopta valores naturales {1, 2, 3…}. El número cuántico secundario, “l”, define la forma del orbital y adopta valores enteros {0, …, n-1} y se asocia con la forma geométrica del orbital; el número l=0, por ejemplo, se asocia con un orbital s (de forma esférica), mientras que el número l=2 se asocia con un orbital p, con forma bilobulada, y los orbitales l=3 son de tipo d y los l=4, de tipo f, de formas mucho más variadas y complejas.
Por su parte, el número cuántico magnético, “m”, indica la orientación espacial del orbital y toma valores enteros desde {-l…, 0,… l}; podría entenderse que, cuando un orbital tiene distintas orientaciones posibles, se definen los llamados “suborbitales”, orientados en distintas direcciones del espacio. El último número cuántico es el número de spin, “s”, y se asocia con una extraña propiedad de las partículas subatómicas de girar sobre sí mismas; sin entrar en muchos detalles, digamos que el electrón puede girar en dos sentidos y que su valor de giro es 1/2, de manera que, para un electrón, s toma los valores +1/2 o -1/2.
Cada electrón, dentro de un átomo, puede identificarse de acuerdo a estos números cuánticos y cada orbital contiene un número del electrones que respetan estos números. Y es importante señalar aquí que cada suborbital puede “almacenar” dos electrones de números de spin distintos: no pueden convivir en el mismo orbital dos electrones con números cuánticos idénticos, lo que viene enunciado por el “principio de exclusión de Pauli”. Es precisamente este principio, junto con el hecho de que los electrones forman una nube de carga negativa alrededor del átomo en lugar de órbitas concretas, lo que determina que los átomos, a pesar de ser espacio vacío en su mayoría, no puedan atravesarse unos a otros y, por tanto, no podamos atravesar paredes o hundirnos en el suelo: la corteza electrónica de los átomos de un muro chocan contra la corteza electrónica de los átomos que nos componen en impiden que se fusionen al estar terminantemente prohibido de forma natural que dos electrones convivan en el mismo estado cuántico. Es más: como ambas nubes electrónicas tienen carga negativa, se repelen entre sí, de manera que, a nivel subatómico, el contacto real no existe: siempre habrá unos nanómetros de separación entre dos cuerpos.
Por ejemplo: para el nivel n=1 de energía, el número l toma el valor n-1 = 0 (orbital de tipo s); como l = 0, m sólo toma un valor: 0, igualmente, lo que quiere decir que si este orbital sólo tiene una orientación posible es que es una esfera. En cuanto al número de electrones que puede alojar, puede tener un electrón con spin +1/2 y otro electrón con un spin -1/2. Es decir: en el nivel 1 sólo hay un orbital s (l=0), de forma esférica y que se llena con dos electrones.
Para el nivel n=2, el número l toma los valores l {0, 1}, presentándose un orbital de tipo s (n=0) y otro de tipo p (n=1). El número m toma los valores m {-1, 0, 1}. Como los orbitales s son esféricos y solo tienen una orientación, las tres posibilidades del número m hacen referencia a las orientaciones de los orbitales tipo p, que pueden estar orientados en los tres ejes del espacio (x, y, z); cada uno de estos suborbitales p puede alojar a susodichos dos electrones, de manera que un orbital p completo puede alojar seis electrones (dos por cada subnivel).
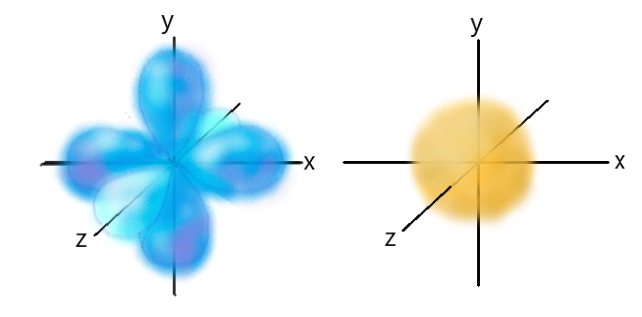
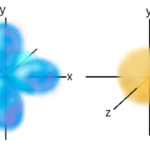
A la izquierda, representación de los tres subniveles de un orbital p, cada uno en uno de los tres ejes del espacio. A la derecha, representación de un orbital s.
Para el nivel n=3, l toma los valores {0,1,2} y m valdrá {-2, -1, 0, 1, 2}. Es decir, que en el nivel 3 hay tres tipos de orbitales: s (l=0), p (l=1) y d (l=2). Como todos los de su tipo, el orbital 3s no tiene más que un subnivel de forma esférica que se copa con dos electrones y el orbital 3p tiene tres orientaciones posibles (m= {-1,0,1}) en los tres ejes del espacio, completándose con seis. Pero el orbital 3d tiene cinco orientaciones posibles (m = {-2, -1, 0, 1, 2}), dividiéndose en cinco suborbitales, cada uno capaz de alojar a dos electrones; es decir, que los orbitales d se llenan con diez electrones. De la misma manera, si hacemos cuentas, los orbitales f tienen siete suborbitales posibles, de manera que pueden alojar hasta catorce electrones.
Las implicaciones de estas capacidades de alojamiento electrónicos son muy profundas, ya que tocan directamente con las capacidades de los átomos de unirse con otros. Y es que, aunque en un átomo neutro hay el mismo número de electrones que de protones, las reglas de distribución de los electrones en la corteza hacen que rara vez los electrones tengan su configuración más estable en estado neutro, sino que necesiten perder, ganar o compartir electrones en su último nivel con otros átomos para formar estructuras estables. Normalmente, es común estudiar que los átomos completan su última capa con ocho electrones (dos electrones alojados en un orbital s más los seis electrones alojados en un orbital p). Sin embargo, la existencia de elementos con orbitales que se completan con diez o catorce electrones hace que algunos grupos de elementos químicos (metales de transición, lantánidos, actínidos…) no respeten esta regla. Gracias al modelo mecano-cuántico del átomo, podemos dar explicación a estos casos que el modelo de Bohr era incapaz de entender.
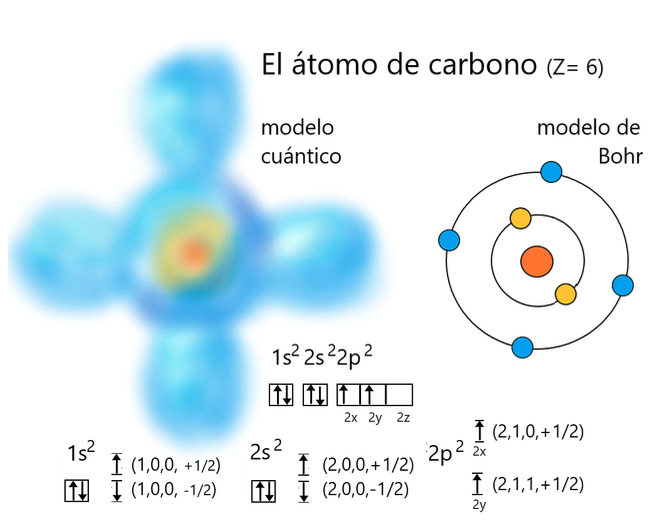
Representación del átomo de carbono de acuerdo al modelo de Bohr y al modelo mecanocuántico, indicando en este último la disposición de los electrones (indicados por flechitas) en los distintos orbitales. Cada electrón tiene una serie de números cuánticos que identifican el lugar donde se le puede encontrar según el nivel, orbital, subnivel y “espín”. Nótese que en cada orbital sólo caben dos electrones con espines opuestos.
 Proyecto Dodociencia es un proyecto por Hidden Nature está bajo licencia internacional Creative Commons Reconocimiento - No Comercial - CompartirIgual 4.0. Creado bajo el proyecto Hidden Nature. Puede encontrar permisos adicionales de los concedidos con esta licencia en nuestras políticas de privacidad
Proyecto Dodociencia es un proyecto por Hidden Nature está bajo licencia internacional Creative Commons Reconocimiento - No Comercial - CompartirIgual 4.0. Creado bajo el proyecto Hidden Nature. Puede encontrar permisos adicionales de los concedidos con esta licencia en nuestras políticas de privacidad